
眼毒理和一般毒理研究中非啮齿类动物眼组织的固定、修块与切片要点(上)
摘要
毒性病理学会(STP,the Society of Toxicologic Pathology)科学和管理政策委员会对当前非啮齿类动物眼组织的固定、修块和切片相关操作进行了技术和科学审查,以确定在制备和评估兔、犬、小型猪及非人灵长类动物的眼组织(用于眼毒理和一般毒理研究)时需考虑的关键点和种属特异性的解剖学标志。本文“注意事项”涵盖的主题包括:确定在何种情况下应实施更全面的眼球或相关眼周组织评估(扩展眼部取材),以及扩展眼部取材的具体内容。此外,本文还强调了眼组织固定、修块和切片的实操要点,以确保对所有主要的眼部结构进行充分的组织病理学评估,包括兔、犬、小型猪和非人灵长类动物视网膜的视锥细胞密集区(视觉条带/黄斑/中央凹),这是当前眼毒理学研究的法规要求。
许多眼部结构呈环状分布于眼球周围,尤其是眼前节。因此,在大多数非啮齿类动物的一般毒理学研究(即非眼部给药途径的研究)中,除在切片中包含视神经乳头外,通常并未特别考虑眼球的修整和切片方向。尽管在许多实验室,眼毒理研究中对眼球进行至少一张切片的组织病理学检查已成为常规,但目前尚无关于该主题的相关建议。此外,非人灵长类动物是唯一在一般毒理研究中会考虑眼后节解剖特征的种属,通常采用水平切片,同时包含视神经乳头和黄斑/中央凹。
近年来,眼科药物发现和安全性研究的进展促使人们重新评估这些传统方法。新型检查手段(如光学相干断层扫描(OCT,Optical Coherence Tomography))的广泛应用,使非临床眼毒理研究中活体期的眼科检查更加细致,从而对显微镜下相关病变的捕捉提出了更高要求。不同实验室在眼毒理研究设计和实施方法上的差异,可能会在对比不同机构研究结果时带来问题,这在多个实验室的研究被整合到同一份法规申报材料中时尤为常见。
当前法规对眼毒理研究的期望包括:(1)对所有的眼组织进行充分的镜检;(2)对足够数量的眼部切片进行镜检,包括对视网膜视锥细胞密集区的评估;(3)结合活体观察结果(包括眼科检查发现)来决定眼球的切片方式;(4)由病理学家对切片/评估方法给出合理说明。尽管对非人灵长类动物眼毒理研究必须评估黄斑和中央凹的要求已广为接受,但对其他非啮齿类动物视网膜视锥细胞密集区(即视觉条带)进行检查的要求仍较为新颖,且对多个切片的需求与当前行业惯例尚不一致。
为应对这些变化,毒性病理学会(STP)科学和管理政策委员会成立了非啮齿类动物眼部修块与切片工作组(NOTS-WG , the Non-Rodent Ocular Trimming and Sectioning Working Group),对当前非啮齿类动物眼球的固定、修块和切片实践进行了科学和技术的评估,以明确在眼部及常规毒理学研究中制备和评估非啮齿类动物眼球及眼外组织时需考虑的关键要点。
本文界定了“扩展眼部取材”的概念,并讨论了其适用于研究的具体场景。此外,本文还介绍了毒理学研究常用的非啮齿类动物(即非人灵长类、小型猪、犬和兔)不同固定和修整方法的优缺点。由于啮齿类动物的眼球较小,不适合复杂的修整,也限制了其在许多眼毒理学研究中的应用,因此本文未涉及。
常规注意事项
PART 01
解剖与组织学考量
视网膜中2种主要光感受器细胞为视杆细胞和视锥细胞。这些细胞是特化的神经上皮细胞,其外节含有嵌入盘膜或内折的细胞质膜中的视觉色素。哺乳动物的视觉色素由一个色素分子(11-顺式视黄醛)与一种视蛋白结合而成,包括视杆细胞中的视紫红质或视锥细胞中的视紫蓝质。光线与视觉色素相互作用,触发细胞膜的超极化。由此产生的电化学信号通过双极细胞和神经节细胞传递,经视神经到达外侧膝状体和大脑的其他视觉处理中心。视杆细胞和视锥细胞在功能上存在特异性差异。视杆细胞是大多数哺乳动物视网膜中的主要光感受器,具有极高的光敏感性,负责黑白和暗光(低照度)视觉。视锥细胞的光敏感性较低,赋予明视(彩色)视觉。在人类及常用的非啮齿类实验动物中,视锥细胞的数量远少于视杆细胞(≤5%),且视锥细胞主要分布于视网膜的特定视锥细胞密集区域,在这些区域赋予了高分辨率视觉(见图1)。
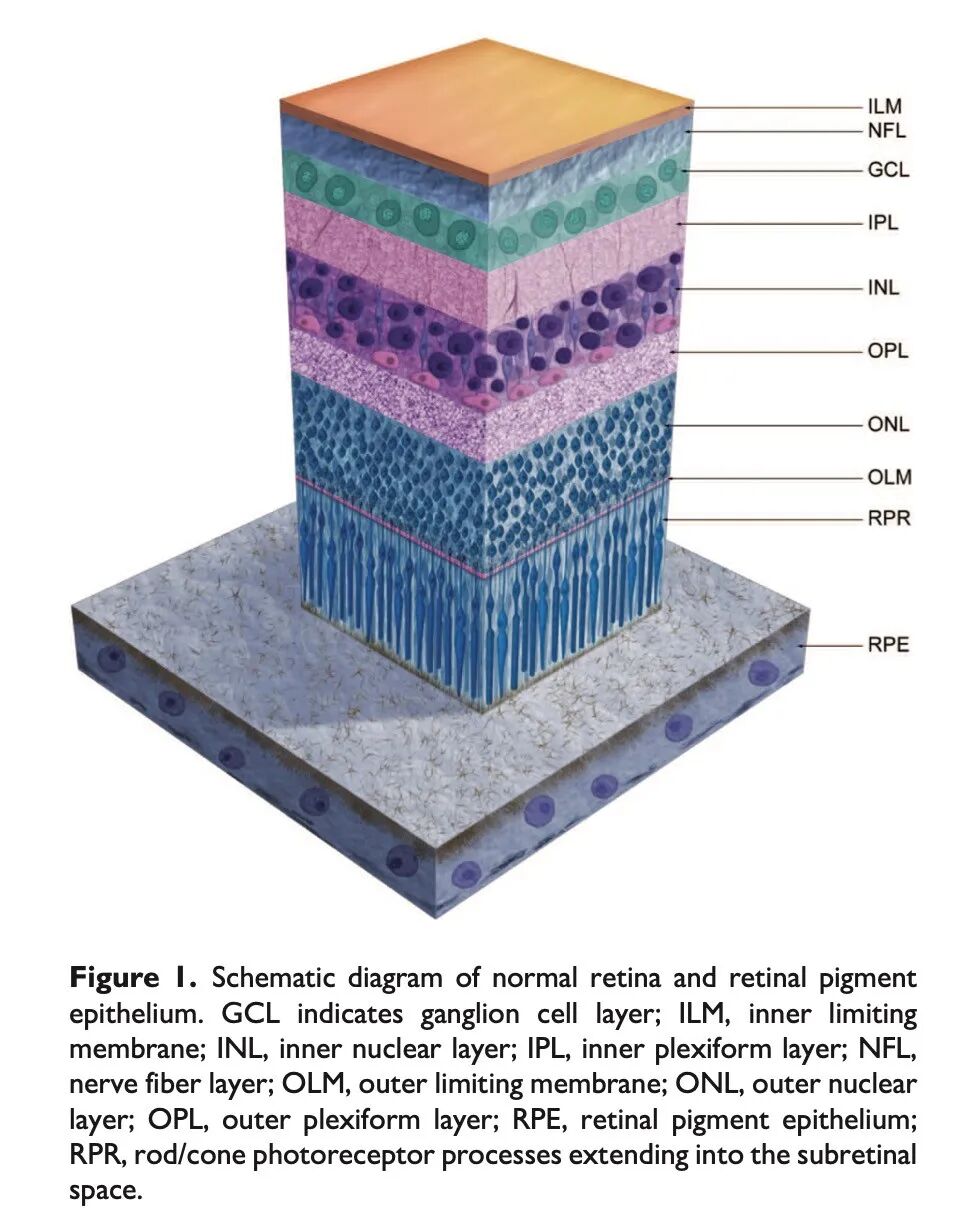
视网膜视锥细胞密集区的形成是由于进化压力,以在特定部位提供增强的视觉敏锐度。这些区域的特征、范围和位置在不同种属间存在显著差异,这种差异从进化角度来看是由环境和行为特征驱动的。
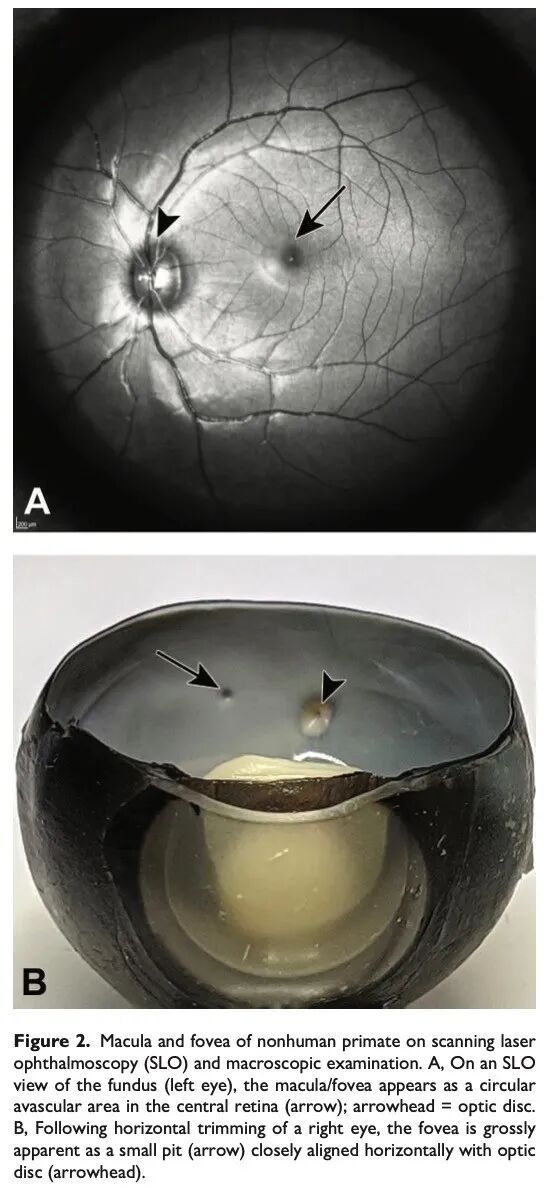
在猕猴和人类等具有中央凹的灵长类动物中,视锥细胞密集区为黄斑/中央凹。通过眼底镜或大体检查,黄斑为视网膜中央颞侧的一个圆形无血管区,因类胡萝卜素色素而呈现出独特的黄色(见图2A和B)。黄斑作为视野的中心及视觉敏锐度最高的区域,具有极高的视锥细胞密度,中央包含中央凹——几乎完全没有视杆细胞的区域。黄斑的组织学特征是神经节细胞层中的神经节细胞密度增加(多排,见图3I),这是由于神经节细胞自中央凹向外离心性移位(见图3J)所致。这种神经节细胞及大多数其他视网膜核层和丛状层的局灶性径向移位,形成了一个小的圆形或椭圆形凹陷,即视网膜中央凹(fovea)。
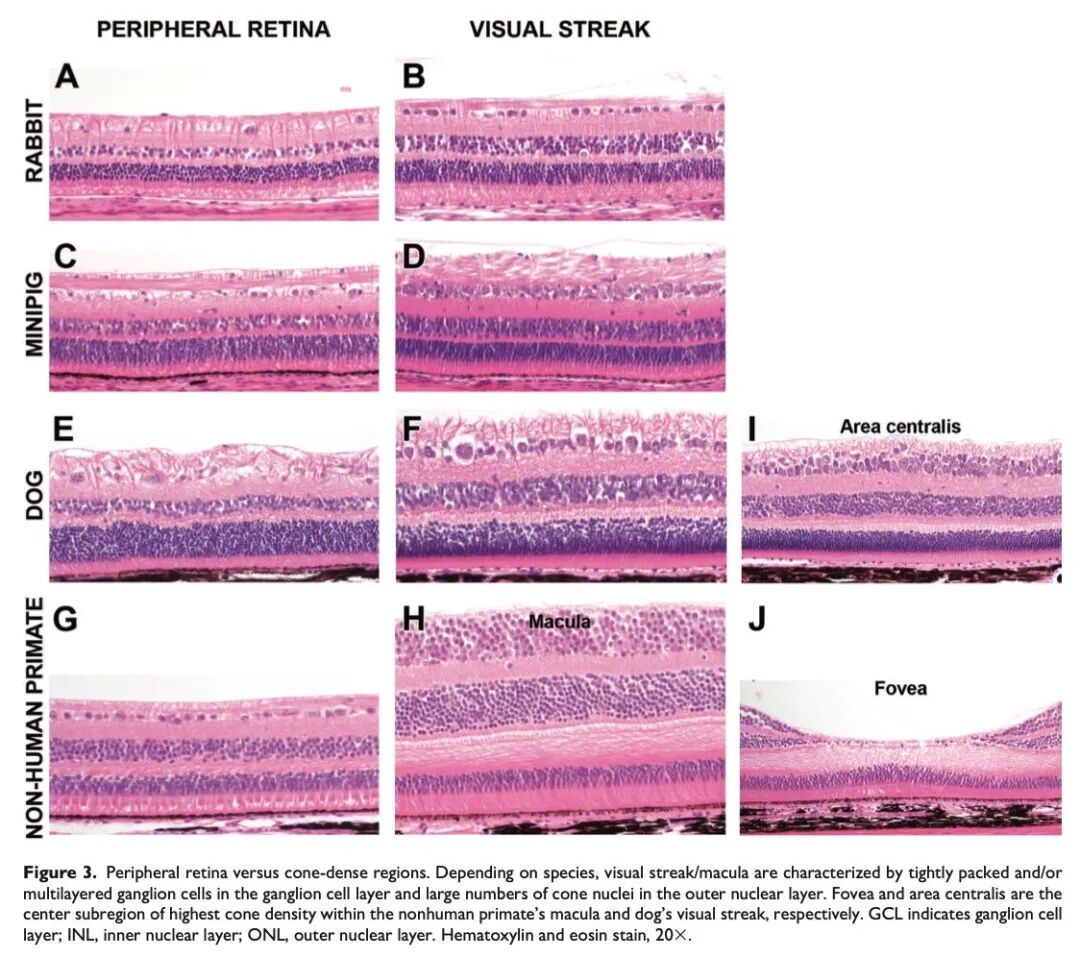
尽管存在一些常见的误解,但灵长类动物并不是唯一具有视网膜锥细胞主导区域的物种。在所有常用的非啮齿类实验动物(如兔、犬和小型猪)中,都已发现视锥细胞密集的视觉条带(visual streaks)。过去,在非灵长类动物中关于相关术语的使用存在一定分歧:有些文献将视觉条带称为中央区(area centralis);在本文中,我们将“中央区”专指视觉条带中视锥细胞密度最高的小而集中的亚区,而在常用于眼毒理学研究的非灵长类物种中,仅在犬的视觉条带中存在这一结构。尽管这些物种都具有视锥细胞密集的视觉条带,但在眼部及一般毒理学研究中,只有非人灵长类动物(NHPs)会对该区域进行常规的取材和检查。
与灵长类动物的黄斑不同,兔、犬和小型猪的视觉条带在检眼镜检查或大体观察下不可见。在这些种属中,视觉条带是一个宽阔、水平分布、逐渐变窄的视锥细胞密集区域,仅能通过组织学检查识别,并可通过神经节细胞密度的增加来辨认(根据不同种属,这些神经节细胞可能形成多层结构,见图3)。
视锥细胞密集区域在视网膜中的位置和大小因种属而异,甚至在同一种属内也存在显著差异(见图4)。在犬的视网膜中,视觉条带为一条位于视盘上方且偏向颞侧的水平带状区域,位于视网膜的毯层(上部)部分。视觉条带向鼻侧延伸的程度不同,且与周边视网膜相比,该区域的神经节细胞数量更多、排列更密集(见图3E和F)。在犬的视觉条带内存在中央区,这是一处位于上方、靠近颞侧、直径约200至300微米的圆形亚区(原文作者的半定量评估),其中神经节细胞紧密排列成2至3层,导致局部视网膜增厚/隆起(部分文献称之为“中央束”(foveal bouquet);见图3E)。类似于灵长类动物的黄斑,犬视觉条带的颞侧部分通常没有较大的血管,这一特征可通过荧光血管造影或OCT血管成像观察到。有趣的是,犬的视觉条带在水平方向向鼻侧延伸的程度在不同个体和品种间差异较大,但中央区的位置(位于视盘上方和颞侧)则较为一致。
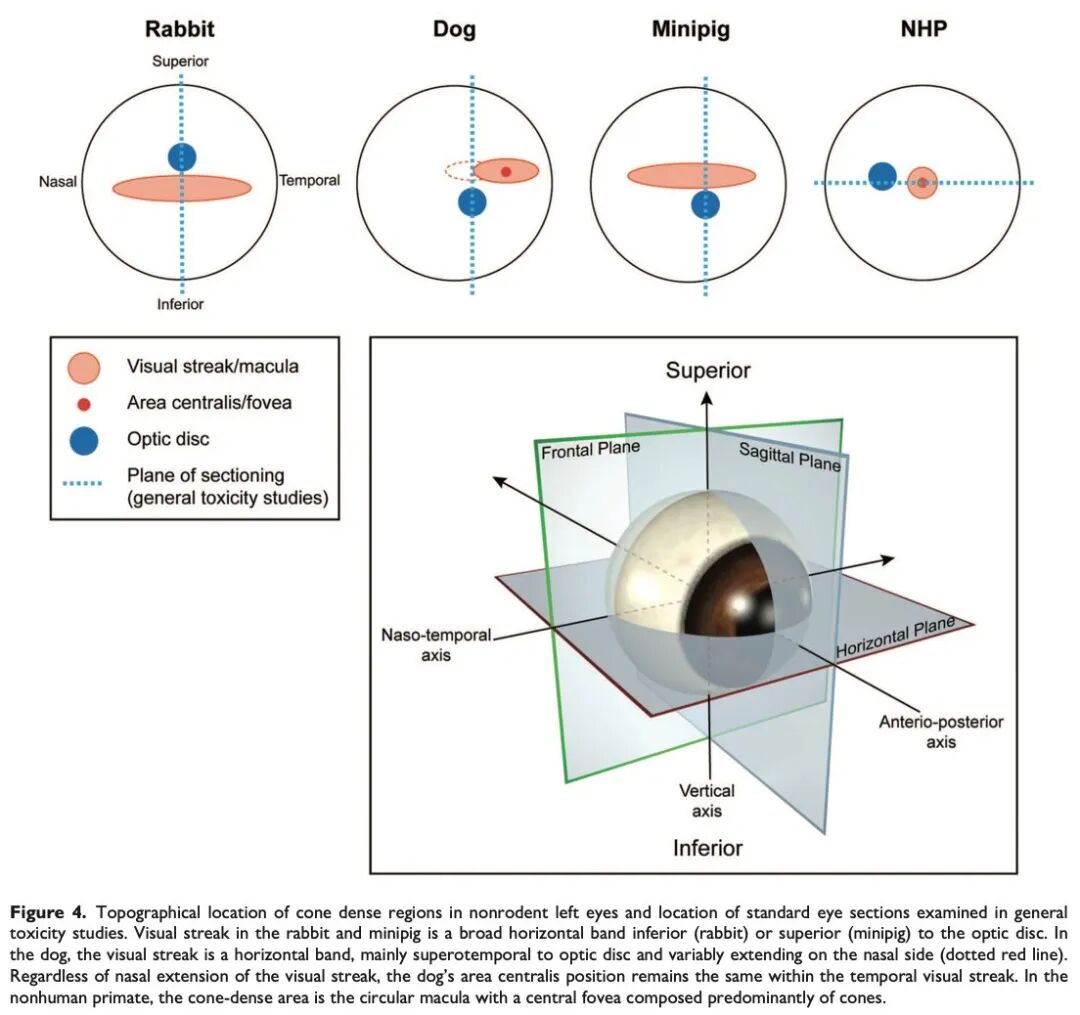
兔和小型猪中的视觉条带比犬的分布范围要广,其特征是有一条神经节细胞和视锥细胞密度增加的横向带状区域,向颞侧和鼻侧延伸。在兔的视网膜中,视觉条带位于视盘和髓射线(以视盘为中心的髓鞘化神经纤维的水平带)的下方,其神经节细胞层为单层,但细胞密度增加(见图3B)。小型猪的视觉条带位于视盘上方,神经节细胞排列紧密呈1-2层(见图3D)。然而,小型猪的视觉条带并不具备犬的中央区所表现出的局部视网膜增厚/隆起特征。尽管在一些关于猪视网膜的文献中,视觉条带被错误地称为中央区,但在小型猪中,神经节细胞密度高的区域应被命名为“视觉条带”,而不应使用“中央区”。
如上所述,视杆细胞和视锥细胞在功能和解剖结构上存在显著差异。此外,视网膜中视锥细胞密集区域的光感受器和神经节细胞密度远高于视网膜周边区域,这对下方的视网膜色素上皮层带来了更高的代谢和吞噬负荷。值得注意的是,大血管通常避开这些细胞密度较高的区域,这些区域主要依赖密集的毛细血管床供血。此外,在这些部位,Bruch膜和内界膜往往更薄。在生化组成、功能及解剖结构等方面的这些差异,可能导致视网膜毒性表现出视锥细胞特异性。尽管存在这种可能性,相关现象在非临床研究中尚未有报道,在人类中也仅偶有观察。因而,针对视网膜视锥细胞密集区域进行检查,对于探究视锥细胞特异性眼毒性的可能性非常重要。否则,若未对该区域进行评估,视锥细胞特异性的毒性反应可能难以被发现。
在一般毒理学研究中,与眼部研究相比,供试品在眼部的暴露量通常较低。由视网膜色素上皮细胞(RPE)、睫状上皮细胞以及视网膜和虹膜毛细血管内皮细胞之间的紧密连接所形成的血-眼屏障,限制了系统给药的供试品在眼部的暴露量。虽然小分子、脂溶性化合物可穿透血-眼屏障,但亲水性化合物和大分子的渗透则受到限制。在毒性病理学中,器官和组织无法被整体检查,通常只对具有代表性的样本进行组织学评估。因此,对于一般毒理学研究,对每只眼建议选取一个切片进行检查,该切片应涵盖所有主要的眼部结构,这是毒性病理学会推荐的做法。NOTS-WG认为,对于无已知眼毒性风险的供试品的一般毒理学研究,采用毒性病理学会的这一推荐做法已足够。然而,在眼毒性研究中,局部暴露量更高,且在眼科检查和眼部组织病理学中更有可能观察到与供试品、给药载体和/或操作相关的发现。另外,一般毒理学研究也可能对眼部产生靶向、非靶向或结构、机制相关的影响,或在眼科检查中发现异常。在这些情况下,仅检查眼球的一个切片可能不够全面,应实施扩展的眼部取材方案,对每只眼进行多个切片的组织病理学评估。
条件允许时,应在制定方案和操作流程前咨询病理学家,以确保采用最佳的剖检、修块和切片方法,以满足具体的研究需求。
PART 02
取材的注意事项一般来说,眼球在剖检时会被完全摘除。为便于在修整过程中进行定位,应在眼球的12点钟方向用缝线或组织染料做标记。左右眼应明确区分,最好分别放入不同的容器,或用组织染料或缝线进行物理标记。
如果特别关注眼附属器、结膜和角膜与病变之间的相互关系(例如,需保持穹窿结膜完整的局部给药研究;或需保持注射药物蓄积部位与邻近眼组织完整的巩膜下或球后给药研究),可对眼球和眼附属器整体进行解剖、固定、修块和切片。
在剖检时采集房水和玻璃体样本有多个意义,包括评估眼内药代动力学和抗药物抗体水平,这些数据可为活体期间的发现(如与免疫原性相关的炎症)提供有益的背景信息。此外,通过采集和利用这些样本,可最大化获得每只实验动物的数据,有助于减少整个开发项目所需的动物数量。
对于非啮齿类动物,在剖检时可通过用25号针头和1毫升注射器穿刺前房,采集至多100微升的房水,这一操作不会引起影响判读的人工假象。玻璃体样本也可采集约100微升的体积,但需注意,用于眼毒性研究的非啮齿类动物的玻璃体通常较为粘稠且成分不均一(即使是NHP),因此所采集的样本可能并不能代表整个玻璃体的情况。采集末期玻璃体样本可能会产生一些牵拉性伪影,尤其是虹膜的屈曲或视网膜的脱离;用组织染料标记采集部位有助于解释可能的人工假象。通过用等体积的固定液替换抽出的玻璃体液,可最大程度地减少人工假象。然而,鉴于玻璃体样本获得的数据往往不一致且难以解释,应权衡玻璃体样本的预期价值与采集后可能影响组织病理学判断的风险。
PART 03
固定和处理的注意事项无论实验设计如何,通常都将整个眼球进行固定,以最大程度地减少人工假象。由于不存在对所有种属、组织或实验流程都“普遍理想”的固定液,因此选择固定液和固定方法时,需根据实验设计和目标进行慎重考虑,包括可能的后续研究和分子病理学观察指标。
对于石蜡包埋组织的光学显微镜检查,在多数眼部和一般毒理学研究中,通常首选Davidson固定液(DS:10%冰醋酸,35%乙醇,2% [37%-40%]甲醛,53%水)或改良Davidson固定液(MDS:5%冰醋酸,15%乙醇,30% [37%-40%]甲醛,50%水)进行浸泡固定。对于较大的非啮齿类动物眼球,建议在DS/MDS中固定24-48小时;应避免固定过长时间,因为DS可能导致眼球过度变硬,并在角膜内皮细胞、视网膜色素上皮细胞、视网膜以及附着的视神经中产生假性空泡。固定后应将组织在流水下彻底冲洗。固定的组织随后可转移至10%中性缓冲福尔马林(10% NBF)或70%乙醇中保存,尽管在这两种固定液中长期保存都不是最佳选择。NOTS-WG认为,DS浸泡固定可为眼组织提供最佳保存效果,尤其是眼局部研究。因为用MDS固定兔眼后,有时会观察到角膜上皮的脱落。对于角膜、前房和晶状体,首选固定液为10% NBF。如为探索性研究,且不关注眼后节,则10% NBF可能是合适的固定液。但由于10% NBF固定后易出现假性视网膜脱离,且视网膜形态细节保存不佳,因此不推荐作为眼球的一般固定液。使用DS/MDS固定时,晶状体易变脆,在切片过程中易发生断裂,产生明显的人工假象。切片前可用液体苯酚或冰醋酸浸泡包埋块表面,以软化晶状体并减轻此影响。另外,切片时,每只眼都应使用新的刀片并缓慢操作。
如果研究的主要目标是免疫组织化学(IHC)或原位杂交(ISH)试验,则可能需使用不同的固定液。虽然许多常用于IHC的抗体在DS固定的组织上也能发挥作用,但针对福尔马林固定后石蜡包埋或冷冻的组织开发和优化的IHC和ISH技术,有时并不能直接应用于DS固定的组织上。对某些IHC和ISH试验,可能需将眼球固定于10%中性福尔马林(NBF)、4%多聚甲醛,或冷冻于OCT包埋剂(optimal cutting temperature compound)中,尽管这些方法会产生人工假象,可能影响视网膜等结构的组织病理学评估。在这种情况下,在取材时向玻璃体内注射10% NBF或多聚甲醛(最多100微升),可能有助于改善视网膜的保存,但也会造成医源性伪影。
对于电镜检查,使用稀释一倍的Karnovsky或Karnovsky改良固定液进行灌流固定可获得眼组织(尤其是视网膜)的最佳固定效果。应注意尽量降低灌流压力,以避免视网膜或视网膜下腔出现假性空泡。如果研究条件不允许灌流固定,建议向玻璃体内注射最多100微升的戊二醛与10%中性缓冲福尔马林(NBF)的1:1混合液,或改良Karnovsky固定液,之后在同一固定液中浸泡5小时,然后将眼球修整为更小的样本。如研究关注视网膜组织,建议去除前节组织,制备“眼杯”。与灌流固定相比,注射或浸泡法技术复杂性较低,但可能导致固定液到达视网膜的时间延长,出现早期自溶性变化,以及类似于玻璃体样本终末采集所产生的人工假象。
如研究涉及对装置的评估或通过装置进行给药,则根据装置的材料以及已有的装置局部耐受性的信息,可能需在固定后修整含有装置的眼部区域,并进行树脂包埋。这样可对装置及相关眼组织进行切片,以评估装置相关的局部反应。在这些情况下,不建议对整个眼球进行树脂包埋,因为这类切片通常较厚。
PART 04
眼球修块与切片的注意事项:拓展性眼部取材
拓展性眼部取材是指为每只眼球制作多张切片进行组织病理学评估,从而实现对眼部结构的全面观察,包括视网膜视锥细胞密集区的评估。以下情形应选用拓展性眼部取材:(1)眼毒性研究,即眼部或眼周给药途径的研究;(2)在靶点或分子类别已知或怀疑存在眼部毒副作用风险的一般毒理研究;(3)在一般毒理研究中出现与供试品相关的眼科检查异常时。此外,拓展性眼部取材还可包括眼周组织,特别是在眼毒性研究中。每项研究所采用的拓展性取材或切片具体范围的方案可根据实际情况调整,但应有充分的科学依据,并根据实验目标量身定制。
拓展性眼部取材适用于所有的眼毒理研究,以及具有靶点或分子类别相关眼部毒副作用风险的毒性研究,或出现与供试品相关的眼科检查异常时。每只眼球应评估至少3张切片,其中至少一张包含视网膜视锥细胞密集区。
眼球修整与切片方法应充分考虑种属特异的解剖和组织学特点,包括视锥细胞密集区特征,来确保关键特征均能在最终的切片中得到适当的呈现,如给药部位、供试品、递送装置及眼科检查的发现。这些方法可根据不同研究的具体需求进行调整,以最大程度满足眼毒理及一般毒理研究的实验目标。体内研究技术团队、兽医、兽医眼科学家、剖检及组织学团队(负责眼球取材、修整、定位和包埋)以及病理学家之间的沟通至关重要,有助于对活体期及组织修整时初步识别的与供试品相关的异常进行全面分析。


