
滴眼给药毒性试验1-目的与试验设计
滴眼给药毒性试验的目的
滴眼给药毒性试验是重复给药一般毒性试验,主要用于研发滴眼药物。欧盟发布的《医疗用品非临床局部耐受性试验指导原则》(CPMP/SWP, 2001)明确规定了单次给药和重复给药眼部耐受性试验的相关事宜。美国食品药品监督管理局发布的《药品以及可替代性给药药品非临床安全性评价指导原则草案》(FDA/CDER, 2008)则明确要求在滴眼给药时应开展系统药代动力学(PK)和眼科检查(包括裂隙灯显微镜检查、眼底检查、眼压测量及组织病理学检查)。然而,这两份指导原则中的相关规定均较简要,缺乏滴眼给药毒性试验详细设计的具体内容。目前,尚无滴眼给药毒性试验的确切定义。日本(卫生福利部,1999)依据ICH M3指导原则(ICH, 2009)和ICH S4指导原则开展滴眼给药毒性试验。这些原则通常适用于系统给药的药物。
有人常常将滴眼给药毒性试验与眼刺激试验混为一谈。实际上,滴眼毒性预试验、一周或两周的重复给药滴眼毒性试验的方案与眼刺激试验的方案有相似之处(OECD, 2012)。
目前,眼刺激试验通常使用兔子进行,以评估化学物质在粘膜给药或人体偶然接触时的安全性(OECD, 2012)。眼刺激试验的主要目的是检测眼表的刺激或腐蚀反应。
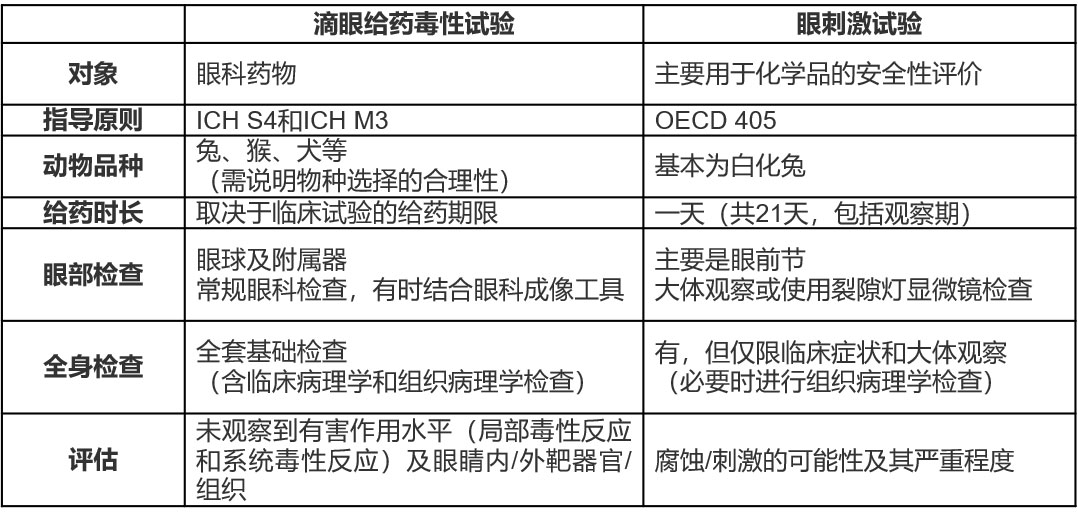
相比之下,滴眼给药毒性试验的主要目的是评估眼科药物的一般毒性。因此,滴眼给药毒性试验的检查项目包括组织病理学检查、眼部附属器以及全身脏器的评价。这两种试验的差异见表1。
表1 滴眼给药毒性试验和眼刺激试验的差异
滴眼给药毒性试验的设计
01、动物物种
根据ICH M3指导原则,一般毒性试验需选择两种动物(ICH, 2009)。通常情况下,会从啮齿类动物(如兔或小鼠)和非啮齿类动物(犬或猴)中各选一种。然而,在过去十年间(2005~2016),经日本卫生劳动福利部(MHLW)批准,约九成的滴眼液在研发过程中,将兔作为开展滴眼给药毒性试验的首选实验物种,其次常用的实验物种是猴(几乎全部是食蟹猴),再然后是犬(见表2)。因此,滴眼给药毒性试验通常选择两种非啮齿类动物。不过,动物物种的选择是根据具体情况而定的。因此,在评估某些药物时,可能仅使用一个物种(比如兔或食蟹猴)。
表2 2005~2016日本滴眼液滴眼给药毒性试验的获批的动物物种
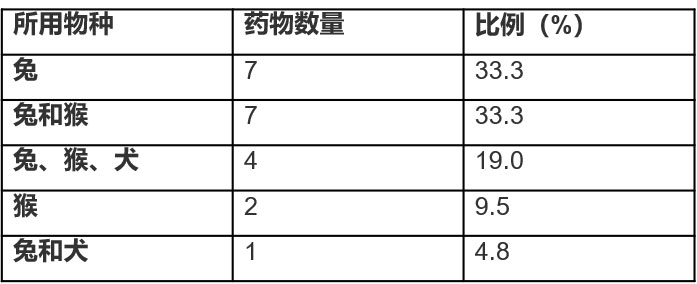
注:信息来源于日本医药和医疗器械局(PMDA)主页
近来发表的多篇文章从眼部安全性评估的角度出发,讨论了各个实验物种的特点,并对不同实验物种作了比较。各物种的特点如下。
兔
兔的眼球重量约为人眼的一半,眨眼频率(每6分钟一次)明显低于人类的眨眼频率(每5秒钟一次)。此外,兔的角膜比人类的角膜薄。基于这些特点,并考虑到影响药物角膜渗透能力的因素,有研究者预计,在滴入滴眼液后,兔眼的药物暴露水平相对较高。McDonald和Shadduck(1977)认为兔相较于其他实验动物对眼刺激物更为敏感。使用兔进行试验的其他原因还包括较低的动物成本以及基于大量供试品积累的历史数据。
在进行滴眼给药毒性试验时,特别需注意选择色素兔还是白化兔。由于供试品能够与色素兔体内的色素结合,因此在毒性评估时,色素兔更具优势。关于色素兔,荷兰带兔比新西兰大白兔和新西兰红兔(F1代兔)更常用于滴眼给药毒性试验。Durairaj等人(2012)报告称,人、食蟹猴、犬、猪、F1代兔和荷兰带兔的眼部黑色素含量存在差异,而且不同物种之间眼睛各部分的黑色素含量也不同。另外,值得一提的是,荷兰带兔的眼球比新西兰大白兔或日本白兔的小。
猴
尽管食蟹猴的眼球重量仅约为人眼的一半,但其解剖特征与人类相似。例如,食蟹猴的角膜和晶状体相对较小,眼底有黄斑。Shibuya等人(2015)建议将食蟹猴用作实验动物,因为它们的眼睛有助于详细评估药物诱导的黄斑病变毒性。食蟹猴的眨眼频率与人类相似。与人类一样,食蟹猴既没有瞬膜,也没有哈氏腺,而兔、犬和猪则都有瞬膜和哈氏腺。食蟹猴和犬一样,也用于系统毒性试验。利用相关物种可以获得毒理学数据,弥合局部给药和系统给药在同一物种中产生的结果差异。与人类相比,食蟹猴的眼组织黑色素含量相对较高。在猴类中,视神经退化常见于恒河猴和食蟹猴,且被认为是自发性先天视神经病变。
犬和猪
针对特定目的饲养的比格犬的眼球重量约为5.5克,约为人眼重量的0.8倍,而猪的眼球大小接近人眼。从眼球的绝对尺寸来看,犬和猪在药物局部效应评估方面具有优势,因为眼组织的厚度和长度是决定局部给药药物渗透性和分布的重要因素。犬和猪的眼部解剖特征相似,例如,与灵长类动物相比,它们的晶状体在眼球中占据的体积相对较大。另一方面,犬的脉络膜上有毯毡层,而猪、兔或食蟹猴则没有。目前,犬和猪不常用于滴眼给药毒性试验,尤其是猪。然而,这类动物在滴眼给药毒性试验中仍有其独特的优势,理由如下:1. 基于上述解剖和生理特点,模仿人体药物分布的可能性较高。2. 与兔和食蟹猴相比,由于犬和猪的体型相对较大,通过系统给药出现的药物反应更少。
02、性别
根据一般毒性试验指导原则(卫生福利部,1999),滴眼给药毒性试验应在两种性别的动物上进行。人类、恒河猴和兔的眼轴长度存在性别差异,但眼球尺寸的性别差异却极其微小。Wagner等人(2008)研究了健康人眼和患病人眼的性别差异,认为性激素影响了不同性别在患病状态下的泪腺系统、眼睑和眨眼频率、以及角膜的解剖和特征。一般而言,干眼流行病学研究表明女性干眼发病率比男性高。然而,实验动物的眼睛是否存在显著的性别差异尚不明确。是否在滴眼给药毒性试验中使用两种性别,尤其仅进行眼毒性评估的试验,仍有待进一步讨论。
03、给药
剂量和浓度
根据ICH M3指导原则(ICH,2009),一般毒性试验的高剂量水平设定为最大耐受量(MTD)、最大给药量(MFD)或人体暴露量的50倍。这一设定原则同样适用于滴眼给药毒性试验。在某些情况下,高剂量水平可以基于局部耐受性预试验的结果来确定。然而,在大多数情况下,滴眼给药毒性试验的高剂量水平是根据MFD设定的,主要是由于制剂制备的某些内在因素。
供试品的角膜渗透性主要取决于制剂的特性。为了获得有意义的风险评估结果,权威性滴眼给药毒性试验(例如首次人体试验之前开展的GLP试验)所用的供试制剂应与临床试验所用的制剂一致或相近。供试品的浓度主要是根据其在制剂中的溶解度来定义的。至于制剂的调整,其他特性(如渗透压、pH值和赋形剂)也十分重要。滴眼液制剂的酸碱度应在可接受的生理范围内。选择防腐剂时,需避免其浓度达到引起毒性反应的水平。例如,有研究者发现,眼科制剂中常用的防腐剂苯扎氯铵在局部给药时会诱发角膜变化。因此,眼科制剂中防腐剂的浓度是有限制的。因此,在大多数情况下,滴眼给药毒性试验所设的最高剂量水平是基于受试制剂的最大给药量,而非供试品本身的特性来决定的。
滴眼体积
兔子的眼睑较为松弛,结膜囊较大,因此能容纳较大的滴眼液体积。根据OECD眼刺激试验指导原则,兔子的滴眼体积为0.1 mL(OECD, 2012)。该体积约为临床标准滴眼液用药体积(约0.04 mL)的两倍。从经验来看,不同物种的最大滴眼体积并不相同。例如,比格犬和兔子的最大可行体积相似,而食蟹猴的最大可行体积则是比格犬和兔子的两倍多。
需注意的是,眼部暴露量并不会随着滴眼体积的增加而成比例增加,因为部分多余的液体会通过鼻泪管流失。Lambert等(1993)假定在眼刺激试验中,如果滴眼体积为0.01 mL(建议供试体积的十分之一),药物与人眼刺激感受的相关性更佳。因此,滴眼给药毒性试验的滴眼体积可能需进一步讨论。增加滴眼体积并不能有效提高眼部暴露量,反而可能导致系统暴露量增加,甚至引发意料之外的系统毒性反应。
单眼/双眼给药
供试品是单眼给药还是双眼给药需慎重考虑。从动物福利的角度出发,若无特殊原因,应将供试品滴入单侧眼睛。如一只眼给予供试品,另一只眼则不给药(即不接触供试品),或给予对照品(例如溶媒制剂)作为对照。然而,严格来说,对照眼由于系统循环的影响,可能也会接触到供试品。因此,在评估对照眼的结果时,应该考虑到这一潜在的接触因素。
给药频率
在标准的口服或静脉给药一般毒性试验中,通常每天给药一次;而在滴眼给药毒性试验中,通常一天给药多次。非临床试验的滴眼频率通常高于临床试验的给药频率。例如,非临床试验中可能每天滴眼4次,而临床试验中则每天滴眼2次。滴眼给药毒性试验设定较高的给药频率,旨在获得更高的重复暴露量,特别是在供试品的生化特征导致最大药物浓度难以增加时更为重要。Chrai等人(1974)报告称,如果两次滴眼间隔5分钟,就能有效地增加兔的眼部暴露量。许多滴眼给药毒性试验的给药频率是临床给药频率的1.5到2倍。然而,给药过于频繁虽可提高暴露水平,但也增加操作的次数,从而增加动物保定的频率,这可能导致动物应激,进而引发伦理问题。因此,在设计滴眼给药毒性试验时,需在提高暴露水平和减少动物应激之间找到平衡点,以确保试验的科学性和伦理性。
04、眼及附属组织检查
常规/标准眼科学检查
滴眼给药毒性试验目前尚无统一的眼部和系统检查项目。OITSs的眼科学检查是基于系统药物一般毒性评估指导原则进行的,涵盖了眼前节、眼内介质和眼底等所有组织的检查(ICH, 1999)。然而,由于滴眼给药直接作用于眼部,滴眼给药毒性试验的眼科学检查更加详细,涵盖的检查项目也更多。Weir和Wilson(2013)列出了非临床眼毒性试验的标准眼部安全性终点,这些终点具有重要的借鉴意义。检查项目包括:大体观察、裂隙灯生物显微镜检查、眼底检眼镜检查、眼压测量、视网膜电图和组织病理学。
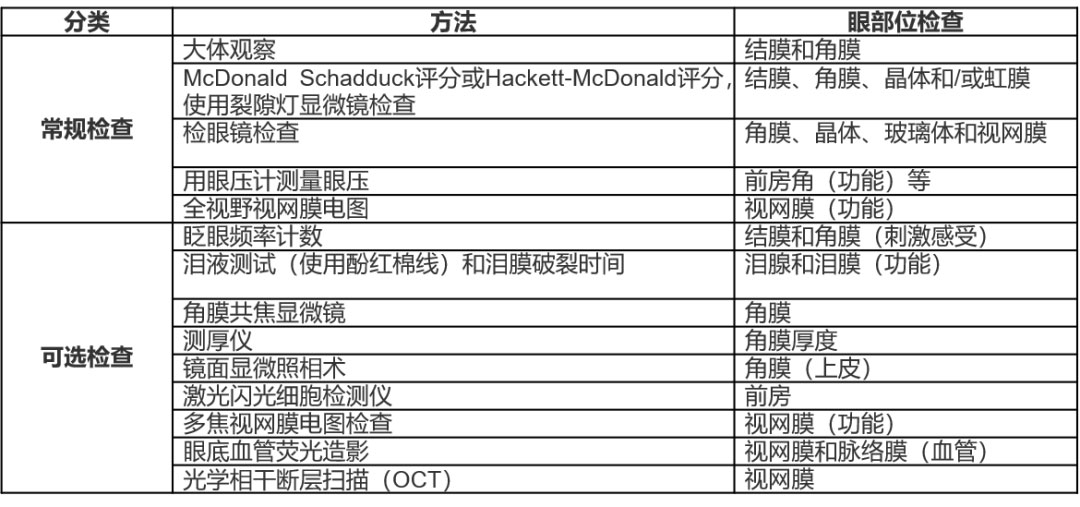
基于相关指导原则和知识,表3总结了滴眼给药毒性试验的常规及可选眼科检查项目。由于眼前节的供试品浓度较高,因此对眼前节进行观察和检查尤为重要。除标准的大体观察外,采用评分方法进行详细观察对于评估眼毒性的严重程度非常关键。例如,Draize评分法用于角膜、虹膜和结膜的大体观察。McDonald Schadduck评分和Hackett-McDonald评分常应用于滴眼给药毒性试验中,二者对裂隙灯显微镜检查结果进行评分。特别是,Hackett-McDonald评分能对眼睛进行全面评估,包括对晶体和瞳孔光反射的评估。
表3 滴眼给药毒性试验的常规或可选眼科学检查
常规检查包括利用检眼镜对玻璃体和眼底进行观察。使用直接检眼镜和间接检眼镜可详细检查眼底。本原则建议,除拍照外,还应简述检查结果并记录,并将这些记录与相应的详细记录一同保存。
眼压是衡量前房角功能变化的重要参数。FDA指导原则提到了使用眼压计的方法(FDA/CDER,2008)。在非临床毒性试验中,常用扁平眼压计、回弹式眼压计或空气式眼压计来测量眼压。在滴眼给药毒性试验中,使用眼压计有几点注意事项。首先,为了获得准确的眼压值,有必要使动物适应眼压计。在测量之前,如果动物没有适应眼压计,通常情况下测出的眼压值会偏高,从而导致无法正确判断药效。其次,由于仪器会接触角膜表面,眼压测量操作可能会在某种程度上损伤角膜上皮细胞。因此,应慎重决定检查的组别及检查顺序,以避免眼部过度应激,并防止过度应激影响其他结果的解读。
通过全视野视网膜电图检查(ffERG)可检测视网膜的功能变化。理想的做法是使用国际临床视觉电生理协会(ISCEV)建议的方法,因为此方法可在进行全视野视网膜电图检查时识别视锥细胞和视杆细胞的变化。然而,此方法不适用于在有限时间内对大量动物进行检查的情况。ISCEV方法拟用于随诊检查,可能仅适用于ERG检查发现异常的情况。例如,Penha等人(2010)报告称,角膜混浊或晶体混浊会影响光线到达视网膜,而麻醉也会影响全视野视网膜电图的检查结果。
可选检查
关于泪膜检查,Schirmer试验和酚红线试验用于泪液体积的定量分析。进行Schirmer试验和酚红线试验时,分别使用无毒滤纸或棉线浸润于pH指示剂酚红溶液中,然后插入结膜囊内进行泪膜检测。泪膜的其他临床检查包括泪膜破裂时间。此前已有研究者报告了犬和兔的泪膜破裂时间,这些测试能够揭示泪腺的功能状态。此外,眨眼频率也可以间接说明供试品是否对角膜产生了刺激。
由于眼科成像技术的进步,现在能检测出常规眼科学检查难以察觉的变化。例如,角膜共焦显微镜检查能够捕捉到角膜上皮的细微变化;角膜内皮显微镜检查能够观察到角膜内皮的形态和密度变化;光学相干断层扫描(OCT)对于视网膜的观察非常有力。这些成像技术均可用于滴眼给药毒性试验中的动物检查,能够生成高分辨率的图像,满足组织病理学检查的要求。
滴眼给药毒性试验的其他常用眼前节检查包括定量测量角膜厚度的测厚仪和定量测量前房房水闪辉的激光房水闪光细胞仪。如果眼后节的视网膜出现局部异常,多焦视网膜电图(mfERG)能够捕捉到相应的电生理信号。利用眼底血管荧光造影能够观察到视网膜和脉络膜的原有血管及新生血管的渗透性。
Kontadakis等人(2014)指出,泪膜中的细胞因子和生长因子作为生物标记物,能预示眼表疾病。有研究者报告称,血清细胞因子是预示老年黄斑变性的生物标记物。生物标记物能用于非侵入性方式观察药物诱导的眼毒性反应。然而,目前这样的生物标记物数量仍然有限。反过来,上述的各种眼部成像技术可能可替代生物标记物,用于观察和研究人和动物的眼毒性。
05、眼及附属组织的病理学检查
组织病理检查是滴眼给药毒性试验的重要组成部分。最近,多篇文献综述一致强调了组织病理学检查在药物评估中的重要性。在滴眼给药毒性试验中,供试品的最大暴露量不仅出现在角膜上皮,还出现在结膜和排泄系统,包括鼻泪管的粘膜和鼻腔。因此,需要特别注意细致检查这些组织。泪腺、哈氏腺(若有)、鼻腔和瞬膜(若有)也应进行组织病理学检查。为了准确地进行组织病理学评估分析,必须严格考量组织病理切片的质量。如今已有多篇关于这一方面的文章发表,详细阐述了切片的各种技术考量。


