
一种罕见病:肝豆状核变性及其动物模型
最近惊闻一位朋友因患一种名为肝豆状核变性的罕见病而离世,突感罕见病并不罕见,它往往就在我们身边。因笔者对肝豆状核变性研究有所涉猎,本文将对该病及其动物模型作简要介绍。
01、首次发现及致病机制
肝豆状核变性又名Wilson病(Wilson’s disease,WD) ,1912年首次由Samuel Kinnear Wilson博士描述。该病表现为“渐进性豆状核退化”,在患者的肝脏和大脑等器官中发现了过量的铜,该病在全球的患病率约为1/30000。经过多年研究,肝豆状核变性(WD)的发病机制已经研究的较为清楚,它是一种常染色体隐性遗传铜代谢障碍疾病[1]。1993年三个独立研究小组几乎同时发现了ATP7B基因为Wilson病的致病基因。该基因编码铜转运P型 ATP酶 ( copper-transporting P-type ATPase,ATP7B)[2],WD患者携带发生突变的ATP7B基因,血清铜蓝蛋白合成及正常的铜代谢过程发生障碍,过量的铜沉积在组织器官中,如肝脏、大脑、肾脏、角膜中,其中最常受累的是肝脏和神经系统[3]。
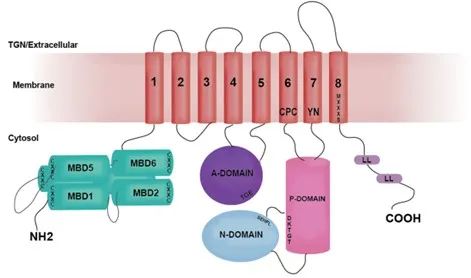
图1.ATP7B蛋白结构图
图注:N-端包含六个结合铜的金属结合结构域(MBD1-MBD6,青色);参与Cu配位的残基在膜内的位置为CPC、YN和MXXXS;位于C末端的两个亮氨酸基序(1459LL和1487LL)对胞吞作用和TGN从质膜重新定位至关重要[4]。
02、临床表现及诊断
WD患者在临床表现上包括严重程度不等的肝损伤、持续性血清转氨酶升高、急性或慢性肝炎、代偿期或失代偿期肝硬化和暴发性肝功能衰竭等[5]。神经系统的表现以椎体外系病变症状为主,包括僵硬、震颤、运动迟缓、构音障碍、吞咽障碍、舞蹈症状、癫痫发作等,精神症状包括躁狂、性格改变、抑郁等[6, 7]。此外肾脏、血液系统及骨关节等器官系统,也会出现相应的临床症状和体征。
患者出现以下一些症状或指标可供临床诊断:
1. 角膜K-F环是某些WD患者一个比较明显的特征。K-F环为角膜边缘的黄绿色或黄灰色色素环,一般在手电筒侧光照射下肉眼可见,7岁以下患者一般无法检出角膜K-F环。
2. 肝脾检查:肝功能血清转氨酶、胆红素升高和(或)白蛋白降低;肝脾B超:常显示肝实质光点增粗、回声增强甚至结节状改变;部分患者脾脏肿大;肝脏MRI检查常显示肝脂质沉积、不规则结节及肝叶萎缩等。
3. 采用铜代谢相关生化检查,铜蓝蛋白<120mg/L,24小时尿铜≥100μg。
4. 颅脑MRI检查主要表现为壳核、尾状核头部、丘脑、中脑、脑桥及小脑T1低信号、T2高信号,少数情况下可出现T1高信号或T1、T2均低信号。
5. 基因筛查:对于临床证据不足但又高度怀疑WD的患者,筛查ATP7B基因致病变异对诊断具有指导意义。
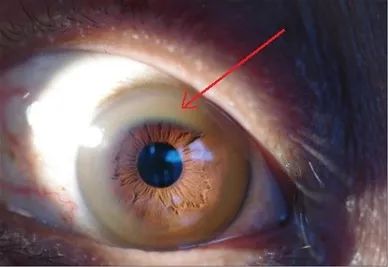
图2. 角膜边缘黄色浑浊的K-F环
03、ATP7B突变类型及地理分布
ATP7B基因突变在不同种族和地域中存在遗传异质性。欧洲人群最常见的突变类型是14号外显子上的 H1069Q突变,在意大利、瑞典和罗马尼亚等地多见,临床主要以锥体外系症状为主,如震颤、肌张力障碍、精神症状等。亚洲人群最常见的突变类型是 8号外显子上的错义突变R778L,以中国、韩国和日本最多见,临床以肝脏方面症状为主,如肝功能异常、肝硬化、肝脾大等;其余常见的还有 P992L、Q1399R等[8]。
04、肝豆状核变性动物模型
1. “毒乳”( toxic milk,TX)小鼠
肝豆状核变性动物模型中最有名的是一种“毒乳”( toxic milk,TX)TX小鼠。 “毒乳”小鼠这一名称源自雌性纯合子TX小鼠乳汁中缺乏铜,因此其哺乳的幼鼠在2周左右时会由于铜缺乏而死亡。后续研究证明“毒乳”为ATP7B基因突变小鼠。
TX小鼠又分为两种,一种是1974年由Harold Rauch在DL近交系小鼠F68代中发现的自然突变,后来(1996年)被鉴定为ATP7B基因外显子20中4066位的A到G碱基变化,导致第八跨膜区M1356V(甲硫氨酸to缬氨酸)的改变。TX鼠于第3周开始出现铜在脏器的沉积,首先是肝脏和脑,以肝脏为重,至第4个月铜沉积最为显著,可达对照组的60~80倍。同期肾脏亦有大量沉积。这种由肝至脑再到肾的铜沉积过程与WD患者的一般临床病程相似[9]。
另一种TX小鼠是1987年在杰克逊实验室的C3H/HeJ群体中出现的自然突变品系TX-J小鼠,现对外出售,编号001576。该突变小鼠是ATP7B基因外显子8中2135位的G到A的碱基突变。与TX小鼠相似,TX-J小鼠与WD患者以相似的方式在肝脏中积累铜,成年纯合子TX-J小鼠会发展为肝硬化。
TX和TX-J小鼠不能完全模拟WD患者,其角膜无K-F环;与WD患者的肝脏损伤也有显著差异;且没有关于人类WD母亲的婴儿铜缺乏现象的报告;另外TX小鼠缺乏明显神经系统症状,TX-J小鼠也只有轻微的行为异常。但TX和TX-J小鼠ATP7B mRNA的转录水平没有明显改变且ATP7B基因功能部分保留,并具有与WD患者相类似的病理过程和铜生化特征,同时也由于其容易获得,是目前使用最多的WD动物模型之一,广泛应用于一些治疗药物的试验。
2. ATP7B基因修饰小鼠
利用同源重组技术或CRISPR基因编辑技术敲除ATP7B基因第2外显子获得的ATP7B-/-基因敲除小鼠也越来越多的被用于WD研究。ATP7B-/-基因敲除小鼠具有与人类WD和TX小鼠相似的铜沉积表型,但与TX鼠模型相比发病较早且肝损伤更严重,肝炎、坏死性炎症、胆管增殖、纤维化,甚至后续的肿瘤发生等症状都比TX鼠更接近人类WD的肝脏病理结果。
随着基因编辑技术的进展,采用基因编辑工具CRISPR/Cas9+ssDNA[10],或采用碱基编辑(Base Editor)、先导编辑(Primer editor)技术,结合胚胎操作术可以较轻松地在小鼠ATP7B基因上构建与人类WD同源的突变位点。理论上可以获得更接近人类WD特征的小鼠模型。
3. LEC(Long–Evans Cinnamon)大鼠
LEC大鼠是一种近交系突变大鼠,最初是从Long–Evans大鼠群体中分离出来的,它的ATP7B基因在3’端编码区缺失了900个碱基,以及下游未翻译区缺失了约400个碱基。LEC大鼠主要表现出自发性肝铜异常积聚伴随低血清铜和低铜蓝蛋白,大约4月龄时出现暴发性肝炎或暴发性肝衰竭、转氨酶和胆红素升高,部分或大量肝细胞坏死,病死率至少30%~40%,存活下来的大鼠多在12月龄时发生肝纤维化并伴有肝细胞癌和胆管癌。由于肝病进展迅速,LEC大鼠特别适合干预治疗研究,如各种排铜络合剂和干细胞治疗研究等。

图3. LEC(Long–Evans Cinnamon)大鼠
4. 其他大型哺乳动物模型
一些大型哺乳动物在铜代谢方面也存在遗传缺陷,均表现出铜在肝脏中积累和铜毒性,例如犬(杜宾犬、拉布拉多寻回犬、贝灵顿梗犬Bedlington Terrier)和北罗纳德赛羊等。然而这些大型哺乳动物铜代谢方面的遗传缺陷与人类WD并不相同,如贝灵顿梗犬,导致其肝铜积累的遗传缺陷是由于COMMD1(MURR1)基因39.7kb的删除,而非ATP7B基因,故作为人类WD模型的作用有其局限性[11, 12]。若能在大型哺乳动物甚至非人灵长类动物的ATP7B基因中引入突变,或将造就更好模拟人类WD的动物模型。
05、肝豆状核变性的治疗
在目前的治疗方案中,WD患者需进行终生治疗,主要目标为治疗铜过载。基本原则包括低铜饮食:避免或限制富含铜的食物,如肝脏、水生贝壳类动物、坚果、巧克力、豆类、蘑菇等。药物治疗方面以青霉胺、曲恩汀为代表的金属络合剂增加铜的排除,以锌剂为代表的药物减少铜的吸收。治疗越早越好,患者通常不能停药,因为治疗中断很可能导致失代偿性肝损伤及神经不可逆损伤。
值得注意的是WD的药物治疗有一定的局限性,除需要终生治疗外,约1/3 WD患者用药期间会出现与药物相关的不良事件,导致不得不更换药物,甚至可能导致治疗失败,WD晚期导致的肝衰竭或失代偿期肝硬化需要进行肝移植,这可能是最后的常规治疗手段。
鉴于WD是非常明确的由ATP7B基因突变所致的疾病,因此基因治疗或许有广阔的前景。目前已有基于动物模型的WD基因治疗研究。如Murillo等在研究中用编码人ATP7B cDNA的AAV8载体转导到ATP7B-/-小鼠模型的肝脏,发现治疗后血清转氨酶降低,尿铜排泄量减少,血清全血浆蛋白的正常化[13]。此外,2019年Liu等通过CRISPR/Cas9替换了小鼠模型中ATP7B基因的第8外显子[14];2020年Michael等使用CRISPR/Cas9+ssODN的方法纠正人类细胞系中的ATP7B点突变[15]。笔者尝试用一种ABE碱基编辑器输入到TX-J小鼠肝脏,观察到了小鼠血清转氨酶降低,以及低比例的肝细胞ATP7B点突变被纠正(数据不展示)。总之,基因治疗的进展为WD患者带来了希望,但基因治疗还处于基础研究到临床研究转化的阶段,还有很多不成熟的地方需要不断完善和革新。期望它将来能成为治疗肝豆状核变性的一线疗法。
参考文献:
1.Wilson, S.A.K., Progressive lenticular degeneration. A familial nervous disease associated with cirrhosis of the liver. Lancet, 1912. 1: p. 1115-1119.
2.Gomes, A. and G.V. Dedoussis, Geographic distribution of ATP7B mutations in Wilson disease. Annals of Human Biology, 2016. 43(1): p. 1-8.
3.Rodriguez-Castro, K.I., F.J. Hevia-Urrutia, and G.C. Sturniolo,Wilson’s disease: A review of what we have learned. World journal of hepatology, 2015. 7(29): p. 2859.
4.Ariöz, C., Y.Z. Li, and P. Wittung-Stafshede, The six metal binding domains in human copper transporter, ATP7B: molecular biophysics and disease-causing mutations. Biometals, 2017. 30(6): p. 823-840.
5.Liver, E.A.F.T.S.O.T., EASL clinical practice guidelines: Wilson’s disease. Journal of hepatology, 2012. 56(3): p. 671-685.
6.Guggilla, S.R., et al., Spectrum of mutations in the ATP binding domain of ATP7B gene of Wilson Disease in a regional Indian cohort. Gene, 2015. 569(1): p. 83-87.
7.Hedera, P., Update on the clinical management of Wilson’s disease. The application of clinical genetics, 2017. 10: p. 9.
8.黄艳,刘志峰, 肝豆状核变性ATP7B基因突变的研究进展.医学综述, 2019. 025(009): p. 1717-1721.
9.Harold and Rauch, Toxic milk, a new mutation affecting copper metabolism in the mouse. J Hered, 1983. 74(3): p. 141-144.
10.朱基彦, et al., 利用CRISPR/Cas9构建R778L类型肝豆状核变性疾病小鼠模型.基础医学与临床, 2018. 38(12): p. 6.
11.杨玉龙, et al., 肝豆状核变性动物模型的研究进展.临床肝胆病杂志, 2022. 38(5): p. 6.
12.Fieten, H., et al., New canine models of copper toxicosis: diagnosis, treatment, and genetics. Human Disorders of Copper Metabolism I, 2014. 1314: p. 42-48.
13.Murillo, O., et al., Long-term metabolic correction of Wilson's disease in a murine model by gene therapy. Journal of Hepatology, 2016. 64(2): p. 419-426.
14.Liu, L.L., et al., Exon Replacement in the Mouse Gene by the Cas9 System. Human Gene Therapy, 2019. 30(9): p. 1079-1092.
15.Pöhler, M., et al., CRISPR/Cas9-mediated correction of mutated copper transporter ATP7B. Plos One, 2020. 15(9).


